La PCR, siglas en inglés de ‘Reacción en Cadena de la Polimerasa’, es una prueba de diagnóstico que permite detectar un fragmento del material genético de un patógeno. Se utiliza cada día en laboratorios de todo el mundo para identificar enfermedades, por ejemplo, la infección por coronavirus. Otro de sus campos de aplicación es la sanidad vegetal. Investigadores del IFAPA muestran el proceso que va desde la recogida de muestras de una planta hasta la obtención de los resultados que indican si contiene o no un patógeno.
La PCR, siglas en inglés de ‘Reacción en Cadena de la Polimerasa’, es una prueba de diagnóstico que permite detectar un fragmento del material genético de un patógeno. Se basa en las características de estabilidad al calor de una enzima polimerasa, que replica material genético. Su hallazgo y posterior aplicación mereció el Premio Nobel de Medicina, concedido a Kary Mullis y Michael Smith en 1993. En los años 80, ambos revolucionaron la genética, ya que la técnica permite copiar una pequeña cantidad de ADN millones de veces de modo que haya suficiente para analizarlo.
Las PCR se utilizan cada día en laboratorios de todo el mundo para detectar enfermedades, por ejemplo, identificar la infección por coronavirus.
Otro de sus campos de aplicación es la sanidad vegetal. En este vídeo los investigadores del Instituto Andaluz de Investigación y Formación Agraria, Pesquera, Alimentaria y de la Producción Ecológica (IFAPA) Ana Aguado Puig; Nieves Capote Maínez; Ana Trujillo Ferrusola; Eduardo de La Lastra Alcalde; muestran el proceso que va desde la recogida de muestras de una planta hasta la obtención de los resultados que indican si contiene o no un patógeno.
Para diagnosticar la infección por SARS-CoV-2, el virus que causa la COVID-19, los investigadores recogen una muestra de la nariz o la parte posterior de la garganta del paciente. En el caso de las plantas, se cogen tejidos vegetales afectados con síntomas.
Los expertos del IFAPA, para diagnosticar una enfermedad causada por hongos, limpian la zona de la planta con síntomas y la colocan en una placa que contiene un medio nutritivo que permite crecer al patógeno a 25-27 grados. En función del hongo, puede tardar en crecer de 2 a 7 días.
Cuando hay suficiente tejido de micelios, es decir, el cuerpo de un hongo constituido por filamentos, se hace una extracción de ADN y se limpia para que esté lo más puro posible. Este material genético purificado se utiliza en la PCR para amplificar una región genética de interés, que permita identificarlo. Se trata de amplificar un fragmento del genoma del patógeno. Sería como hacer un ‘zoom’ a un trozo de material genético y, a modo de ‘fotocopiadora’ de genes, la técnica lo replica hasta 40 millones de copias del fragmento inicial.
Qué es la prueba PCR ‘en directo’
La PCR también puede amplificar una región del código genético del virus, para detectarlo y cuantificarlo ‘en directo’. En esta detección en tiempo real, se incorpora un componente que hace que las moléculas sean fluorescentes denominado fluoróforo. Éste está dentro del tubo donde están los reactivos de PCR y la muestra de ADN, de forma que cuando se hacen copias de la región genética de interés, se incorpora en las cadenas de ADN y emite una fluorescencia que es captada por el equipo donde se han introducido los tubos.
Una vez detectado, un ordenador acoplado al equipo de PCR mide el aumento de fluorescencia en los casos positivos y la no fluorescencia en el caso de los negativos.
Qué es la prueba PCR convencional
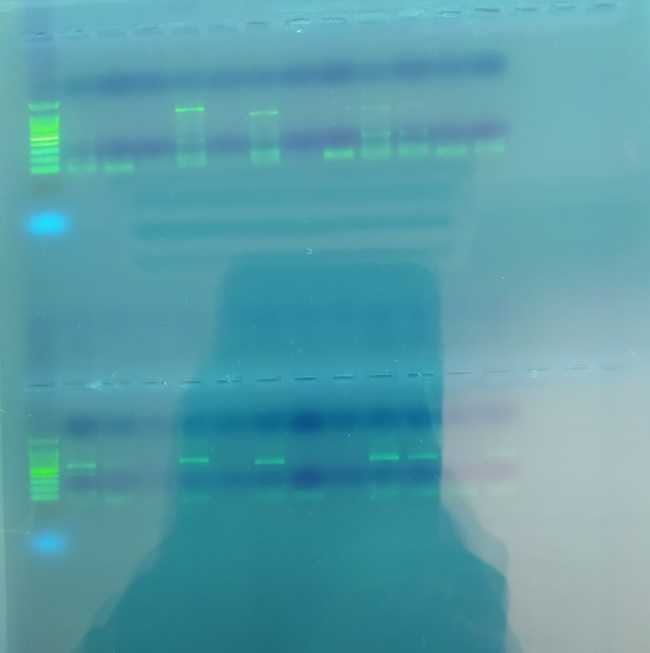
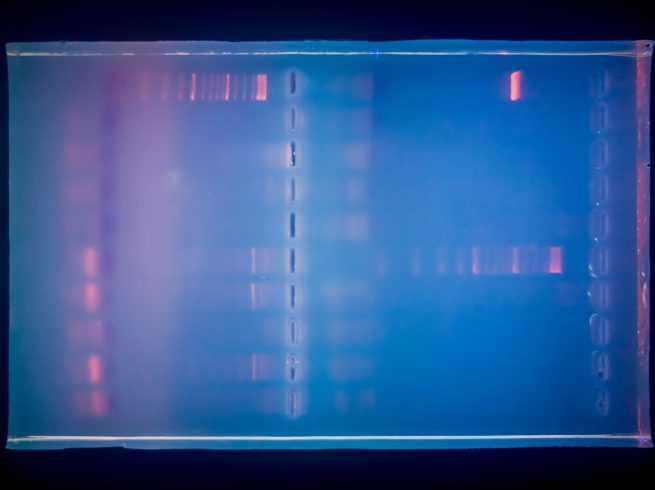
Cuando no incluye fluorescencia, la PCR es convencional y el método para ver las zonas de interés es tintarlas. En este caso, las muestras se introducen en un gel de agarosa, un fluido procedente de algas, al que se añade un tinte que permite ver las bandas de ADN en una pantalla de luz ultravioleta.
Para ello se utiliza la electroforesis, una técnica para la separación de moléculas de ADN que se desplazan del polo negativo al polo positivo cuando son sometidas a un campo eléctrico.
¿Cómo se sabe el tamaño de la ‘fotografía’ de ADN que se toma?
Para ello, se introduce el gel tintado en una caja y se deposita verticalmente en una especie de peine. Cuando el gel se solidifica se retiran las púas de este peine y cada diente origina un hueco que sirve de pocillo para la muestra. En el primer pocillo se introduce un ADN cortado en distintos tamaños que indica el tamaño de la región de ADN que se amplifica.
En los demás huecos se va introduciendo cada una de las muestras obtenidas en la PCR. Si la muestra es positiva, se observará una banda de un tamaño determinado y si es negativa, no se muestra la banda o será de pequeño tamaño.
La PCR requiere conocimiento experto para su realización, pero aporta múltiples ventajas: es muy específica, ya que puede diferenciar entre dos microorganismos muy cercanos evolutivamente. Asimismo, resulta muy sensible, ya que puede detectar cantidades de 20 copias/ml, o incluso menos, de material genético viral o de cualquier organismo. Por último, es precoz porque detecta virus en las primeras fases de la infección.
Suscríbete a nuestra newsletter
y recibe el mejor contenido de i+Descubre directo a tu email