Investigadores de varias instituciones españolas han descrito un nuevo mecanismo de reparación de ADN que usan los tumores para escapar a los tratamientos contra este tipo de cáncer.
Para las células son muy importantes los mecanismos de corrección de errores, porque en la rica actividad celular constantemente hay fallos de funcionamiento. Pero cuando se trata de matar células cancerosas lo que interesa es precisamente provocar errores. La radioterapia y la quimioterapia los provocan rompiendo el ADN de las células. Sin embargo, hay células tumorales que tienen una maquinaria de reparación excepcionalmente eficaz, y esto les permite escapar al tratamiento contra el cáncer.
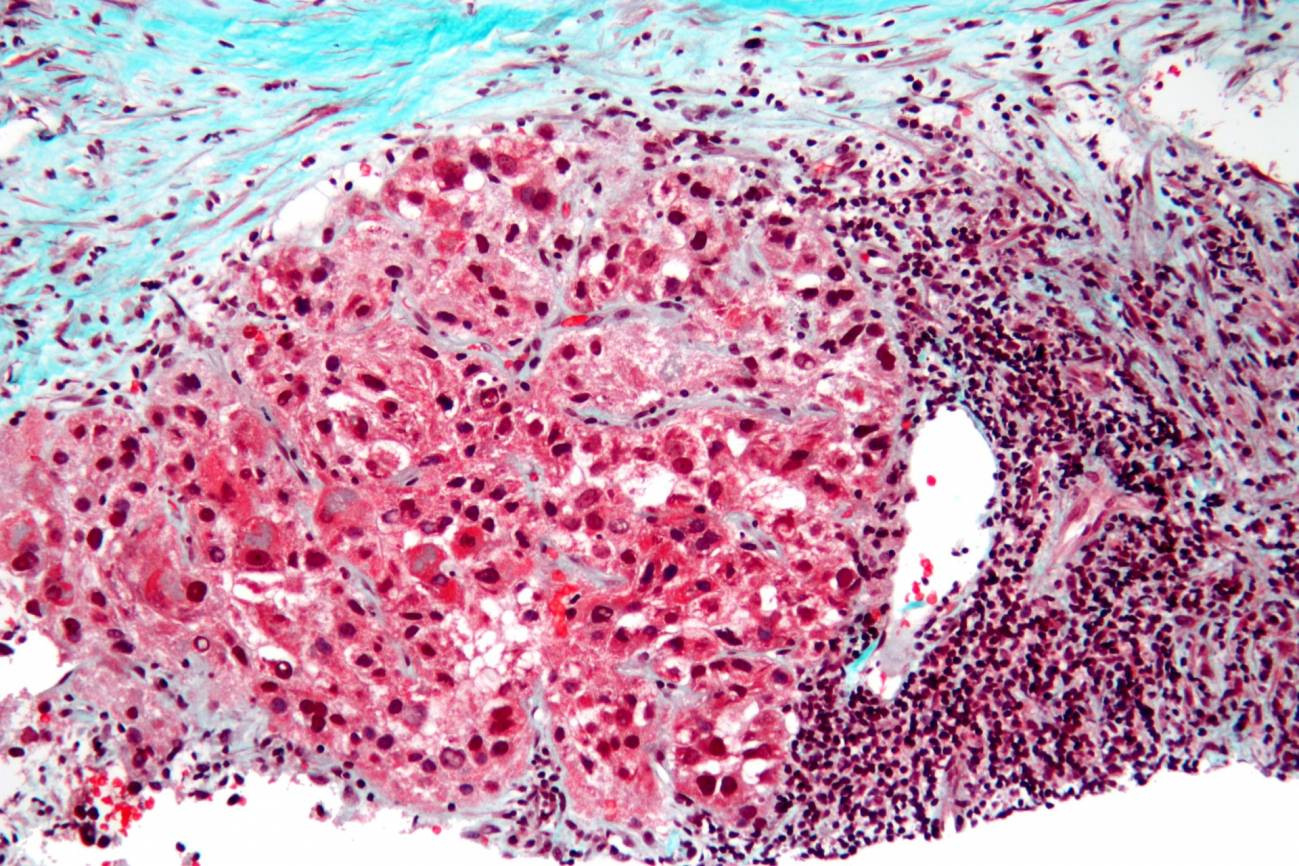
Imagen de microscopio de un carcinoma hepatocelular, el tipo más común de cáncer de hígado. / Wikipedia
Un equipo liderado por Óscar Llorca, del Centro Nacional de Investigaciones Oncológicas (CNIO); Fernando Moreno-Herrero, del Centro Nacional de Biotecnología (CNB) y Puri Fortes, del CIMA-Universidad de Navarra, desvelan ahora en un trabajo en Cell Reports cómo funciona uno de estos sistemas excepcionales de reparación: una grapa molecular que una novedosa técnica nanotecnológica muestra por primera vez en acción.
Objetivo: eliminar la molécula NIHCOLE
El equipo de Fortes descubrió hace unos años que aproximadamente la mitad de los pacientes de carcinoma hepatocelular (el cáncer de hígado más común) producen una molécula de ARN, llamada NIHCOLE, que está sobre todo en los tumores más agresivos y se asocia con un mal pronóstico. Fortes, Llorca y Moreno-Herrero concluyeron que esta molécula a reparar muy eficazmente el ADN roto, y por eso la radioterapia es menos efectiva en aquellos tumores en que está presente. Eliminando NIHCOLE, las células cancerígenas tratadas con radioterapia mueren más fácilmente.
Pero los investigadores no conocían el mecanismo molecular por el que dicha molécula facilita la reparación de roturas en el ADN. El nuevo estudio lo explica: NIHCOLE forma un puente que une los fragmentos del ADN roto.
“NIHCOLE interactúa simultáneamente con proteínas que reconocen los dos extremos de un ADN fragmentado, como si los grapara”, explican Llorca y Moreno-Herrero.
Comprender este mecanismo puede ayudar a diseñar estrategias para combatir el cáncer de hígado de peor pronóstico. “El uso de fármacos inhibidores de NIHCOLE puede representar una terapia novedosa para el cáncer de hígado más frecuente”, indican estos investigadores.
Nanopinzas magnéticas para estirar DNA
Para entender cómo actúa NIHCOLE el grupo de Fernando Moreno-Herrero ha usado pinzas magnéticas, una técnica de nanotecnología que hace posible estudiar las características físicas de las moléculas por separado.
Los investigadores han diseñado una molécula de ADN que mimetiza un ADN roto, y que permite detectar la unión entre los dos extremos fragmentados. Primero pegan a uno de los extremos del ADN una bolita magnética minúscula, de milésimas de milímetro; después, con pinzas magnéticas, tiran de ese extremo.
La longitud del ADN estirado informa de si se trata de un ADN reconstituido, en el que los extremos rotos se han pegado, o si, por el contrario, sigue habiendo fractura
Un ‘ADN basura’ que ya no lo es
NIHCOLE no es una proteína sintetizada por un gen, sino una molécula de ARN. Forma parte de lo que se produce a partir de lo que hace dos décadas, cuando se secuenció el genoma humano, los biólogos llamaban ‘ADN basura’. Creían, erróneamente, que no servía para nada.
NIHCOLE es una de estas moléculas de ARN largas, cuya existencia y funciones se conocen hace tan poco que aún maravilla a los biólogos. Sorprende también que basta un pequeño trozo de ella para ejercer el efecto de grapa molecular.
“Esto permitiría desarrollar fármacos que bloqueen o distorsionen esta estructura, y así mejorar la eficacia de la radio o la quimioterapia en pacientes con cáncer”, afirman los autores del trabajo.
Referencia bibliográfica:
De Bragança et al. “APLF and long non-coding RNA NIHCOLE promote stable DNA synapsis in non-homologous end joining”. Cell Reports, 2023.
Suscríbete a nuestra newsletter
y recibe el mejor contenido de i+Descubre directo a tu email