Un estudio realizado por expertos del Instituto de Biomedicina de Sevilla (IBiS) describe cómo toxinas procedentes de hongos y denominadas ribotoxinas son incapaces de interaccionar funcionalmente con los ribosomas para detener su actividad y promover la muerte celular hasta que éstos no alcanzan un punto muy avanzado en su maduración.
Un estudio publicado en la revista Nucleic Acids Research por expertos del Instituto de Biomedicina de Sevilla (IBiS), describe cómo las ribotoxinas son incapaces de interaccionar funcionalmente con los ribosomas, para detener su actividad y promover la muerte celular, hasta que éstos no alcanzan un punto muy avanzado en su maduración.
Las ribotoxinas, toxinas procedentes de hongos, actúan sobre los ribosomas, bloqueando su actividad y provocando la muerte de la célula que atacan. Saber en qué momento del proceso de maduración ribosómica actúan estas toxinas es importante para la búsqueda de aplicaciones terapéuticas para enfermedades relacionadas con ese proceso, como son el cáncer, muchas enfermedades neurodegenerativas, y un grupo de enfermedades heredables conocidas genéricamente como ribosomopatias. Son enfermedades afortunadamente de las llamadas raras (afectan a una parte reducida de la población). Aunque los síntomas de estas enfermedades ‘raras’ son diversos, todas tienen en común manifestaciones hematológicas tales como anemia y aplasia medular. Entre las más conocidas se encuentra la denominada Anemia de Diamond-Blackfan.
Este trabajo es resultado de la colaboración del grupo del IBiS liderado por el profesor de la Universidad de Sevilla Jesús de la Cruz, con el conocido grupo ‘Estructura-Función de Proteínas’ dirigido por el profesor Álvaro Martínez del Pozo de la Universidad Complutense de Madrid y el grupo de investigación del Dr. Panse en la Universidad de Zürich en Suiza.
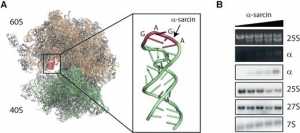
Las ribotoxinas son toxinas proteicas muy potentes, normalmente procedentes de hongos; son estudiadas en áreas de investigación muy diversas tanto para el control de plagas de insectos en cosechas como para su uso en inmunoterapias en cáncer. En concreto, la alfa-sarcina, producida por una variedad de Aspergillus, fue descubierta en 1965 dentro de un programa de investigación estadounidense en busca de nuevos agentes antitumorales; su nombre lo recibe por su potente actividad anti-sarcoma. Las ribotoxinas son proteínas pequeñas con actividad endoribonucleasa altamente especializadas que cortan un enlace fosfodiester concreto en el RNA ribosómico de una estructura universalmente conservada, el lazo sarcina-ricina, la cual es esencial para la síntesis de proteínas. La importancia crítica de esta región del ribosoma durante la síntesis de proteínas explica que no sea accesible hasta etapas muy tardías citoplásmicas de su maduración, como el estudio ha puesto de manifiesto. El trabajo también ha permitido demostrar que la acción de la alfa-sarcina sobre el proceso de traducción proteica se ejerce in vivo durante la etapa de elongación.
Este trabajo ha sido realizado con un versátil modelo eucariota, la levadura Saccharomyces cerevisiae. Este microrganismo ofrece la posibilidad del análisis genético, el cual, los distintos grupos de este consorcio, pretenden ahora explotar para comprender íntimamente el mecanismo de acción de la ribotoxina. Se pretende también realizar un estudio estructural cuyo objetivo es comprender de manera precisa como la alfa-sarcina interacciona con el ribosoma. El conocimiento detallado del mecanismo de acción de la alfa-sarcina y otras ribotoxinas es esencial para el diseño de nuevas herramientas con utilidad biotecnológica y biomédica.
Suscríbete a nuestra newsletter
y recibe el mejor contenido de i+Descubre directo a tu email