Conexiones entre la síntesis y el plegamiento de proteínas
Expertos del Instituto de Biomedicina de Sevilla, en colaboración con la Universidad de Friburgo (Suiza), y los institutos Karolinska (Estocolmo, Suecia) y EMBL (Heidelberg, Alemania) han participado en un trabajo en el que se ha logrado identificar una conexión funcional entre dos sitios esenciales del ribosoma eucariótico. Para que las proteínas desempeñen correctamente su función es esencial su plegamiento óptimo. De forma incorrecta, induce la degradación de las mismas, con consecuencias sobre la actividad y funcionalidad celular. Esta agregación patológica de proteínas es característica de numerosas enfermedades neurodegenerativas graves como Alzheimer, Parkinson o Hungtinton, así como la diabetes tipo II.
El grupo ‘Síntesis y función de los ribosomas’, liderado por el doctor Jesús de la Cruz en el Instituto de Biomedicina de Sevilla en colaboración con la Universidad de Friburgo (Suiza), y los institutos Karolinska (Estocolmo, Suecia) y EMBL (Heidelberg, Alemania) han participado en un trabajo en el que se ha logrado identificar una conexión funcional entre dos sitios esenciales del ribosoma eucariótico, el centro peptidiltransferasa y el túnel de salida del péptido naciente, de modo que los procesos de elongación traduccional y de plegamiento de proteínas se encuentran íntimamente acoplados. Los resultados han sido publicados en la revista Nucleic Acids Research.
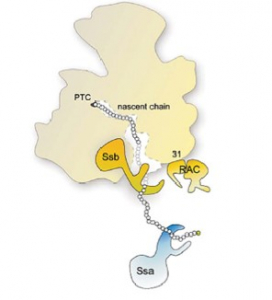
El estudio se ha realizado utilizando el versátil microorganismo modelo Saccharomyces cerevisiae o levadura genética.
Se conoce bien que para que las proteínas desempeñen correctamente su función es esencial su plegamiento óptimo. Este proceso comienza de manera co-traduccional y es llevado a cabo por proteínas denominadas chaperonas que se unen a la salida del denominado túnel polipeptídico del ribosoma. El plegamiento incorrecto de proteínas induce la degradación de las mismas, sin embargo, en determinadas circunstancias patológicas, las proteínas mal plegadas forman agregados insolubles que se acumulan en las células, teniendo importantes consecuencias sobre la actividad y funcionalidad celular. La agregación patológica de proteínas es característica de numerosas enfermedades neurodegenerativas graves, tales como la enfermedad de Alzheimer, de Parkinson o de Hungtinton, así como de otras patologías como la diabetes tipo II.
El estudio se ha realizado utilizando el versátil microorganismo modelo Saccharomyces cerevisiae o levadura genética. Así, mutaciones específicas en los residuos más cercanos al centro peptidil-transferasa en proteína ribosómica uL3 causan letalidad cuando se combinan con la pérdida de función de los sistemas de chaperonas Ssa y Ssb-RAC asociadas al ribosoma. El posterior análisis de la dinámica traduccional mediante la novedosa técnica 5’PSeq ha permitido concluir que la pérdida de viabilidad celular se debe, entre otras cosas, a la inhibición de la elongación temprana de la traducción proteica que induce un incremento en la agregación de las proteínas en proceso de síntesis, también llamadas cadenas polipeptídicas nacientes. La gran conservación estructural y funcional de los ribosomas y sus chaperonas asociadas en el dominio eucariota permitirá la extrapolación de estos resultados a células humanas para el estudio molecular de la patología de enfermedades conformacionales producidas por el plegamiento anómalo de proteínas.
Referencia bibliográfica: Rodríguez-Galán, O., García-Gómez, J.J., Rosado, I.V., Wei, W., Méndez-Godoy, A., Pillet, B., Alekseenko, A., Steinmetz, L.M., Pelechano, V., Kressler, D. and de la Cruz, J. A functional connection between translation elongation and protein folding at the ribosome exit tunnel in Saccharomyces cerevisiae. Nucleic Acids Res. 49: 206-220, 2021. doi: 10.1093/nar/gkaa1200.
Suscríbete a nuestra newsletter
y recibe el mejor contenido de i+Descubre directo a tu email




