Genes, moléculas y proporciones para regenerar el corazón
Un equipo de investigación de la Universidad de Jaén ha definido el papel de dos agentes reguladores del proceso por el que se forma el corazón. Este descubrimiento contribuye a su comprensión y plantea posibles aplicaciones futuras en medicina regenerativa, como la reparación del daño provocado tras un infarto.
Leonardo da Vinci demostró con su Vitruvio que la anatomía humana era una obra de arte matemática y perfecta. Simboliza la búsqueda de la simetría, donde cada parte del cuerpo guarda una proporción ideal. Esta visión de armonía refleja una concepción de la naturaleza como un sistema intrincado y bien ordenado, en el que cada elemento cumple una función esencial.
Siguiendo esta idea de equilibrio, los avances en biología molecular han comenzado a revelar las proporciones invisibles que guían el desarrollo de los órganos. Descubrir la red de conexiones entre las distintas moléculas que se incluyen en el organismo nos revela el complejo diseño del ser humano, donde cada proceso celular tiene su propio ritmo y propósito dentro de un sistema perfectamente coordinado.

Estefanía Lozano, Diego Franco, Sheila Caño, Carlos García y Juan Manuel Castillo, autores del artículo.
Esta idea se refleja hoy en el estudio publicado en la revista Cellular and Molecular Life Sciences por un equipo de investigación de las universidades de Jaén, Málaga y Granada, la Fundación Medina de Granada, el Centro Nacional de Investigaciones Cardiovasculares y el Centro de investigación Biomédica en Red de Enfermedades Cardiovasculares. En él confirman uno de los procesos biológicos que dan forma al corazón, revelando cómo las moléculas y señales celulares orquestan, con precisión, el desarrollo de nuestros órganos vitales.
Interruptores en el corazón
El ADN contiene la información genética de cualquier ser vivo. A partir de una región concreta, la célula produce una copia llamada ARN, responsable de llevar instrucciones a las células y permitir que se fabriquen proteínas o se regulen otros genes. Esa cadena se procesa y recorta para producir pequeñas moléculas, llamadas microARNs. No se convierten en proteínas, sino que se unen a otros ARN mensajeros para bloquearlos o degradarlos, controlando así qué genes se expresan. De esta manera, funcionan como ‘interruptores’ de los genes, activando unos o desactivando a otros para que el organismo funcione de forma orquestada.
Los resultados de este trabajo, realizado con líneas celulares y ratones, demuestran que dos de estos ‘interruptores’, llamados miR-495 y let-7c, intervienen de manera decisiva en la migración de células del epicardio, un movimiento clave para que esta capa celular llegue a recubrir el corazón en el desarrollo embrionario. Así, han dibujado un mapa molecular mucho más detallado que el que se conocía hasta el momento, ya que muestra no sólo qué genes participan, sino también cómo se comunican entre sí los distintos niveles de regulación.
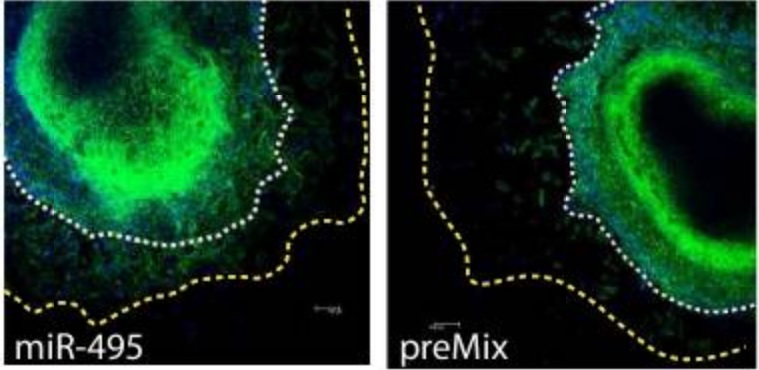
Los expertos han comparado los perfiles de ARN en dos momentos críticos del desarrollo del corazón de ratones.
Los expertos han comparado los perfiles de ARN en dos momentos críticos del desarrollo del corazón de ratones observando que estos microARNs son regulados por el factor de transcripción Foxf1, una proteína que actúa como ‘director de orquesta’ del proceso. “Foxf1 regula a let-7c, éste regula a otros genes y microARNs, y todo este entramado permite que las células epicárdicas se muevan y se diferencien hacia otros tipos celulares correctamente, creando una intrincada red de control genético. Es decir, estos microARNs funcionan como ‘interruptores maestros’ dentro de un sistema de interruptores más pequeño”, indica a la Fundación Descubre la investigadora de la Universidad de Jaén Estefanía Lozano, autora del artículo.
Aunque este trabajo se ha realizado en modelos de ratón y se centra en una etapa muy temprana del desarrollo embrionario, las redes reguladoras descritas podrían ser similares en humanos. Esto abre la puerta a nuevas investigaciones sobre cómo los defectos en estos microARNs o en Foxf1 podrían relacionarse con malformaciones cardíacas congénitas. “Lo esencial es que el estudio demuestra que el corazón no solo se construye gracias a genes que codifican proteínas, sino también a través de un sutil diálogo entre moléculas pequeñas que ajustan al detalle cada decisión celular”, añade la investigadora.
Seguir las huellas genéticas
La investigación parte de un enfoque que combina biología molecular, análisis bioinformático y experimentación en modelos celulares para revelar mecanismos que antes eran invisibles. Los científicos querían entender cómo se forma el epicardio durante el desarrollo embrionario, así que compararon dos etapas clave en ratones: el proepicardio, la estructura inicial, y el epicardio embrionario ya establecido.
Para ello, tomaron tejidos en las diferentes etapas del desarrollo embrionario, analizando todos los tipos de ARN presentes. De esta manera, observaron qué genes y microARNs estaban más o menos activos al pasar de proepicardio a epicardio.
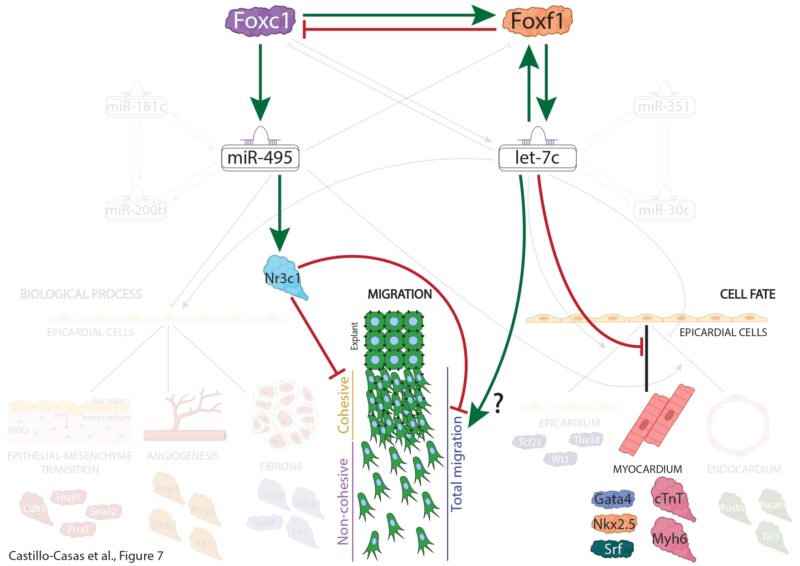
Foxf1 regula a let-7c, éste regula a otros genes y microARNs, y todo este entramado permite que las células epicárdicas se muevan y se diferencien.
De esta manera, determinaron que miR-495 y let-7c, tenían un papel central en controlar la migración de las células epicárdicas y también en regular a otros microARNs. Así, comprobaron en líneas celulares cómo afectaban a la migración y a la diferenciación celular. Además, identificaron que el factor de transcripción Foxf1 controlaba la actividad de let-7c.
Con toda esta información, construyeron un ‘mapa’ de interacciones que explica cómo se coordinan genes, microARNs y factores de transcripción para que el epicardio se forme correctamente.
Los expertos plantean estudiar con más detalle cómo otros microARNs y proteínas reguladoras interactúan para controlar la formación del epicardio y la diferenciación cardíaca y si estas mismas redes reguladoras existen en el desarrollo del corazón humano, para entender malformaciones congénitas. También consideran investigar sobre qué ocurre cuando estos microARNs o Foxf1 no funcionan correctamente para relacionarlo con enfermedades cardíacas o defectos de desarrollo, lo que podría abrir vías para terapias regenerativas, por ejemplo, reparando corazones dañados tras un infarto.
En cierto modo, estos investigadores están trazando su propio Vitruvio del corazón. Crean un dibujo invisible y preciso, en el que cada gen, cada microARN y cada proteína ocupa un lugar exacto dentro de una arquitectura biológica que permite la formación y posible regeneración de este órgano vital. Así como Leonardo buscaba representar la proporción perfecta del cuerpo humano, la ciencia actual comienza a delinear las proporciones moleculares que hacen posible su existencia.
Más información en #CienciaDirecta: Identifican dos moléculas que controlan la regeneración celular del corazón
Suscríbete a nuestra newsletter
y recibe el mejor contenido de i+Descubre directo a tu email




