El bloqueo de NGFR reduce drásticamente las metástasis en ganglio linfático en modelos animales. De progresar en pacientes, este tratamiento se convertiría en uno de los primeros para hacer frente a la metástasis en sus etapas más iniciales, cuando hay más posibilidades de detener su progresión. NGFR podría servir también como importante biomarcador de metástasis temprana del melanoma para definir grupos de riesgo y anticiparse al avance de la enfermedad.
“No solo hay que mirar dentro del tumor, sino también fuera”, afirma el científico del Centro Nacional de Investigaciones Oncológicas (CNIO), Héctor Peinado. Cómo los tumores manipulan su exterior para poder avanzar es una de las grandes preguntas cuya respuesta persigue desde hace años. Durante décadas, “los investigadores se han centrado en estudiar el comportamiento intrínseco del tumor para combatirlo, pero no en todo lo que les rodea”.
Peinado lidera en el CNIO el Grupo de Microambiente y Metástasis, que estudia los mecanismos implicados en la progresión metastásica, entre ellos cómo unas nanopartículas liberadas por los tumores llamadas exosomas manipulan el microambiente tumoral para favorecer las metástasis.
En un trabajo que publica esta semana Nature Cancer, el grupo describe cómo tiene lugar este proceso crítico para el avance del melanoma: los exosomas viajan y se hospedan en el ganglio centinela —ganglio linfático donde se produce inicialmente la metástasis—, desde donde preparan a distancia el entorno propicio —el nicho premetastásico— para favorecer la metástasis.
En este trabajo han observado que la molécula NGFR dirige todo este proceso, y su bloqueo reduce drásticamente las metástasis en modelos animales. Esta reducción se consigue mediante la molécula THX-B, que ya está siendo testada para el tratamiento de otras patologías, lo que acelerará su posible uso para el tratamiento de tumores.
Los científicos proponen también NGFR como un nuevo biomarcador de metástasis temprana del melanoma para definir grupos de riesgo y anticiparse a ella. “Un mayor número de células metastásicas que expresan NGFR en el ganglio centinela se correlaciona con un peor pronóstico de la enfermedad”, comenta Susana García Silva, coprimera autora.
No existen marcadores de enfermedad temprana ni predicción de la enfermedad, de ahí la importancia no solo de nuevos tratamientos, sino de un diagnóstico temprano y preciso para mejorar el pronóstico de los pacientes.
Adelantarse a la metástasis
La metástasis es la responsable del 90 % de los fallecimientos por cáncer. En la mayoría de los casos se diagnostica demasiado tarde. “Si conseguimos detectar que un tumor va a metastatizar, incluso antes de que suceda, será más fácil tratarlo y seremos capaces de frenarlo”, señala Peinado. Aunque los exosomas (nanovesículas expulsadas por todos los tipos celulares, incluidas las células tumorales) se descubrieron hace más de 30 años, hasta hace pocos años no han sido ampliamente estudiados.
En 2012 Peinado descubría en el laboratorio de David Lyden, en EE UU, cómo las células tumorales liberan los exosomas, que transfieren información biológica al microambiente que las rodea para educarlo y favorecer la metástasis incluso antes de que las propias células tumorales viajen por el organismo. “Hasta hace pocos años el microambiente que rodea los tumores pasaba desapercibido. Ahora sabemos que la comunicación de los tumores con su entorno local y el resto del organismo es fundamental para entender el cáncer y sus complicaciones”, declaraba en 2015.
Después de siete años de exhaustivos análisis, los investigadores han descrito que los exosomas liberados por las células del melanoma son reclutados por las células linfáticas endoteliales de los ganglios linfáticos. En estas células, los exosomas promueven —a través de la molécula NGFR— una mayor ramificación de la vasculatura linfática y la adhesión de células tumorales que permitirán su supervivencia y su migración a otros lugares. “Los exosomas de las células de melanoma secretan NGFR para corromper el comportamiento de las células endoteliales linfáticas y facilitar la metástasis”.
Posible primer tratamiento contra esta metástasis
“Sabíamos que las células de melanoma que inician las metástasis incrementan la producción de NGFR, pero no se sabía nada sobre un posible papel de NGFR en exosomas y su influencia fuera del tumor”, explica Peinado. Una vez descubierto el papel de esta molécula en el desarrollo temprano de la metástasis del melanoma, el equipo decidió estudiar las consecuencias de su bloqueo en la expansión de las células tumorales.
Para ello, utilizaron una aproximación genética, en la que eliminaron NGFR de los exosomas, y una aproximación farmacológica en la que emplearon el inhibidor de NFGR, denominado THX-B. En ambos casos, las metástasis se redujeron drásticamente, lo que abre la vía a un posible nuevo tratamiento para combatirlas. Esta terapia se convertiría en una de las primeras para hacer frente a la metástasis en sus etapas más iniciales, cuando hay más posibilidades de hacerle frente.
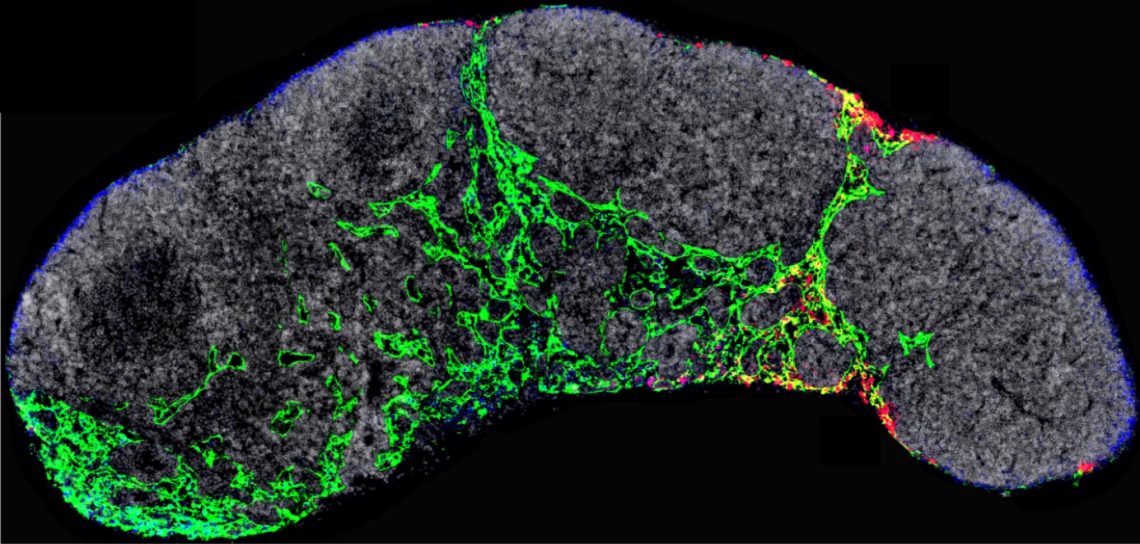
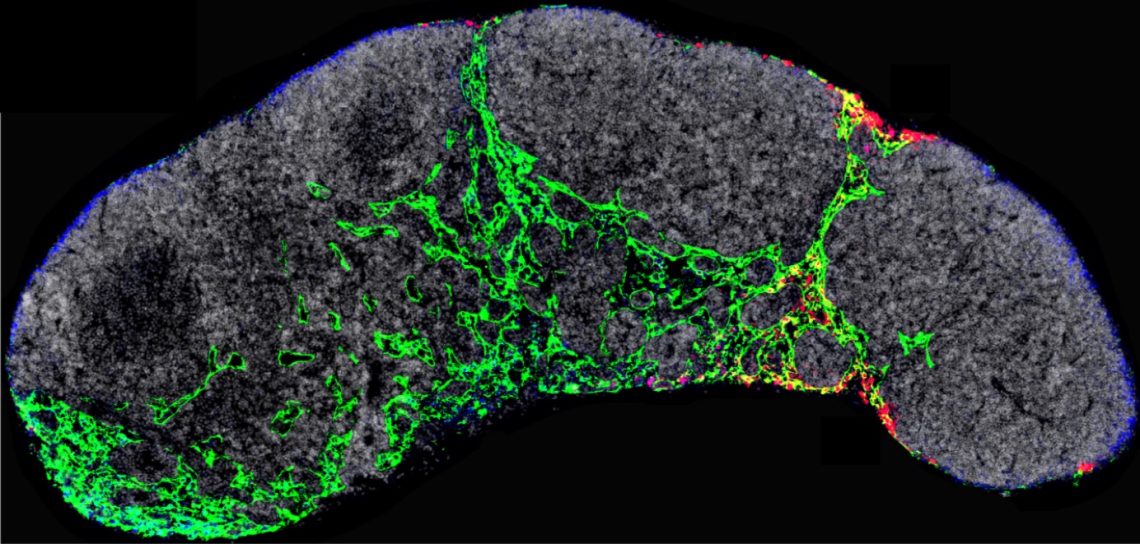
Ganglio linfático de un ratón en el que se visualizan los capilares linfáticos (verde) y los exosomas tumorales (rojo) que dirigirán los primeros momentos de la metástasis. / CNIOEl inhibidor THX-B se está estudiando para el tratamiento de otras enfermedades como la retinopatía diabética, pero no se había explorado su efectividad para el tratamiento del cáncer. Ahora, los expertos están desarrollando su uso para aplicarlo en la clínica. Estos resultados podrían ampliarse al bloqueo de la metástasis en otros tipos de tumores que sobreexpresan NGFR.
Por último, el trabajo muestra en pacientes con melanoma que el número de células metastásicas que expresan NGFR en los ganglios linfáticos predice la evolución de la enfermedad. “El análisis de estas células en los ganglios linfáticos podría servir de importante biomarcador de su progresión y diagnóstico temprano”, concluye el investigador.
Referencia bibliográfica:
García-Silva et al. Melanoma-derived small extracellular vesicles induce lymphangiogenesis and metastasis through a p75NTR/NGFR-dependent mechanism. Nature Cancer, 2021. DOI: 10.1038/s43018-021-00272-y
Suscríbete a nuestra newsletter
y recibe el mejor contenido de i+Descubre directo a tu email