Investigadores de la Universidad de Cádiz han identificado conexiones neuronales responsables de la modulación del dolor y la sintomatología depresiva derivados del padecimiento de dolor crónico.
Investigadores de la Universidad de Cádiz (UCA), miembros del grupo de investigación en Neuropsicofarmacología y Psicobiología, pertenecientes al Instituto de Investigación e Innovación Biomédica de Cádiz INiBICA (CO9) y al Centro de Investigación Biomédica en Red de Salud Mental CIBERSAM (G18 – CB/07/09/033), han identificado conexiones neuronales responsables de la modulación del dolor y la sintomatología depresiva derivados del padecimiento de dolor crónico. Los estudios, dirigidos por la profesora Esther Berrocoso y el recientemente desaparecido profesor Juan Antonio Micó, han culminado con la publicación ‘Pain and depression comorbidity causes asymmetric plasticity in the locus coeruleus neurons’ en la revista Brain.
Los resultados, publicados en la revista ‘Brain’, identifican conexiones neuronales responsables de la modulación del daño y la sintomatología depresiva derivados de su padecimiento.
Muchos de los pacientes con dolor crónico son susceptibles de padecer enfermedades mentales, como los trastornos por depresión o ansiedad. Sin embargo, “siguen sin conocerse adecuadamente los mecanismos neurobiológicos implicados, imposibilitando su adecuado tratamiento”, según explica la profesora Berrocoso.
Por ello, este grupo de investigación se ha centrado en estudiar los mecanismos biológicos implicados en un tipo de dolor, el neuropático, cuyo abordaje terapéutico sigue siendo muy complejo. En concreto, puede tener diversos orígenes: “como consecuencia de la compresión de un nervio (por ejemplo, debido a un tumor, una hernia discal, al síndrome del túnel carpiano), también en el caso de que exista un daño nervioso que afecte a todo el organismo (diabetes mellitus), a una zona concreta (dolor debido a una culebrilla (herpes zoster) o incluso a un procesamiento anómalo de las señales dolorosas como ocurre en el dolor del miembro fantasma”.
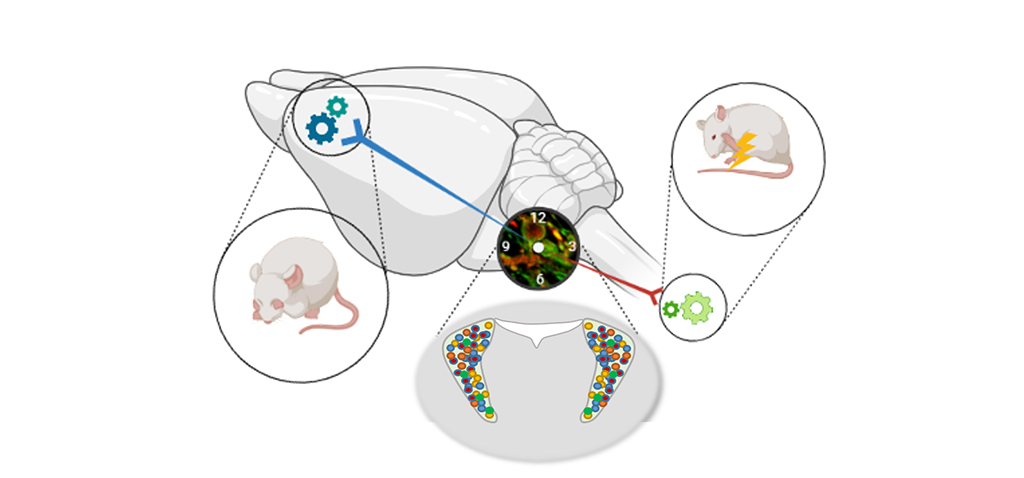
Los científicos de este estudio se centran en el locus coeruleus, principal núcleo noradrenérgico del sistema nervioso central, que tiene un papel relevante en el procesamiento del dolor y conecta la médula espinal con áreas corticales encargadas del procesamiento sensorial y emocional del dolor.
Mediante aproximaciones metodológicas novedosas como DREADDs (siglas en inglés de Designer Receptors Exclusively Activated by Designer Drugs), que permiten modular selectivamente la actividad de las neuronas, han demostrado que “las conexiones del locus coeruleus con la médula espinal tienen un papel relevante en el alivio del dolor solo al inicio de la neuropatía, sugiriendo que se produce un agotamiento de la función analgésica endógena”. Además, interrumpiendo la conexión con la corteza cingulada anterior se alivia la conducta depresiva observada en los animales con dolor neuropático. Asimismo, “mediante un estudio farmacológico se reconoció la participación de receptores alfa-adrenérgicos en la corteza cingulada anterior responsables del fenotipo depresivo”, como describen los autores.
Estos resultados evidencian que el dolor crónico provoca diferentes cambios en el sistema nervioso central a lo largo del tiempo. Así, en los estadios iniciales del proceso doloroso “se producen unas adaptaciones mediadas por la vía descendente noradrenérgica hacia la médula espinal que reducen el dolor que el sujeto experimenta. Sin embargo, cuando el proceso doloroso persiste en el tiempo se produce la activación de conexiones desde el locus coeruleus hacia la corteza cingulada anterior que favorecerían la aparición de síntomas relacionados con la depresión”. En otras palabras, “la acción de la noradrenalina es beneficiosa a nivel espinal con un papel analgésico, pero puede ser contraproducente en áreas cerebrales superiores provocando efectos indeseables”.
Estos hallazgos podrían contribuir a explicar por qué los actuales fármacos antineuropáticos que promueven la activación noradrenérgica requieren de otros mecanismos de acción complementarios tales como la modulación de canales iónicos (gabapentina), serotonérgicos (amitriptilina o duloxetina) o incluso opioides (tapentadol y tramadol). Por tanto, este estudio prueba “la relevancia de la búsqueda de nuevos abordajes terapéuticos personalizados para frenar la cronificación del dolor y las patologías mentales asociadas”, como ha concluido su coordinadora, Esther Berrocoso.
Referencia bibliográfica:
Meritxell Llorca-Torralba, Carmen Camarena-Delgado, Irene Suárez-Pereira, Lidia Bravo, Patricia Mariscal, Jose Antonio Garcia-Partida, Carolina López‐Martín, Hong Wei, Antti Pertovaara, Juan Antonio Mico, Esther Berrocoso, Pain and depression comorbidity causes asymmetric plasticity in the locus coeruleus neurons, Brain, 2021;awab239, https://doi.org/10.1093/brain/awab239
Suscríbete a nuestra newsletter
y recibe el mejor contenido de i+Descubre directo a tu email






